تلعب الإنزيمات دوراً حيوياً في التفاعلات الكيميائية داخل الكائنات الحية، فهي لا تُساهم فحسب في استمرار حياة الكائن، بل مسؤولة أيضاً عن التنفس وعمليات الأيض والنمو وكل الأنشطة الحيوية.
تستهدف الإنزيمات مناطق مُحددة يتبعها حدوث تفاعلات كيميائية تزيد عن 5 آلاف نوع من التفاعلات المتقاربة، لذلك كيف يتعرف الإنزيم على المنطقة التي يجب التفاعل معها والتأثير فيها؟
يمكن الإجابة على هذا التساؤل من خلال التعرف على تركيب بروتين الإنزيمات.
التراكيب الداخلية للإنزيمات
تعمل التراكيب الداخلية للبروتين (الهياكل الأولية والثانوية والثالثية) على تحديد نشاط الإنزيم ودرجة تخصصه وتحديد المادة المتفاعلة أو المادة الهدف التي سيشارك الإنزيم في التفاعل معها.
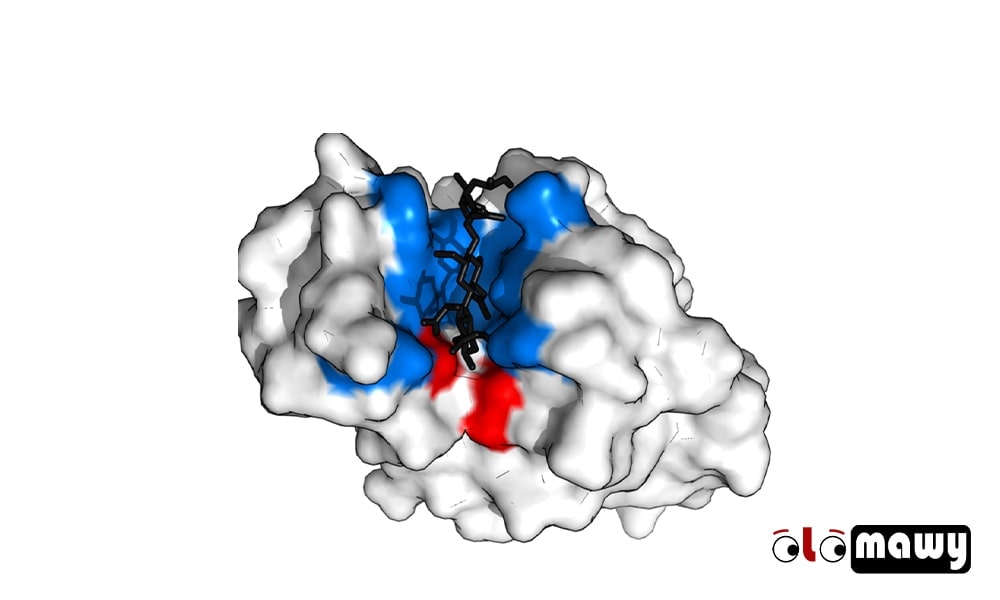
وعلى ذلك يُشار إلى منطقة حدوث التفاعل بين الإنزيم والمادة المتفاعلة باسم “الموقع الفعال للإنزيم” وهي المسؤولة عن قيام الإنزيم بمهمته وجذب المادة المتفاعلة المناسبة له.
إذا كان بإمكاننا تغطية الإنزيم بقطعة جلد رقيقة، فإن الموقع النشط سيبدو دائماً وكأنه حُفرة أو كهف داخل الإنزيم.
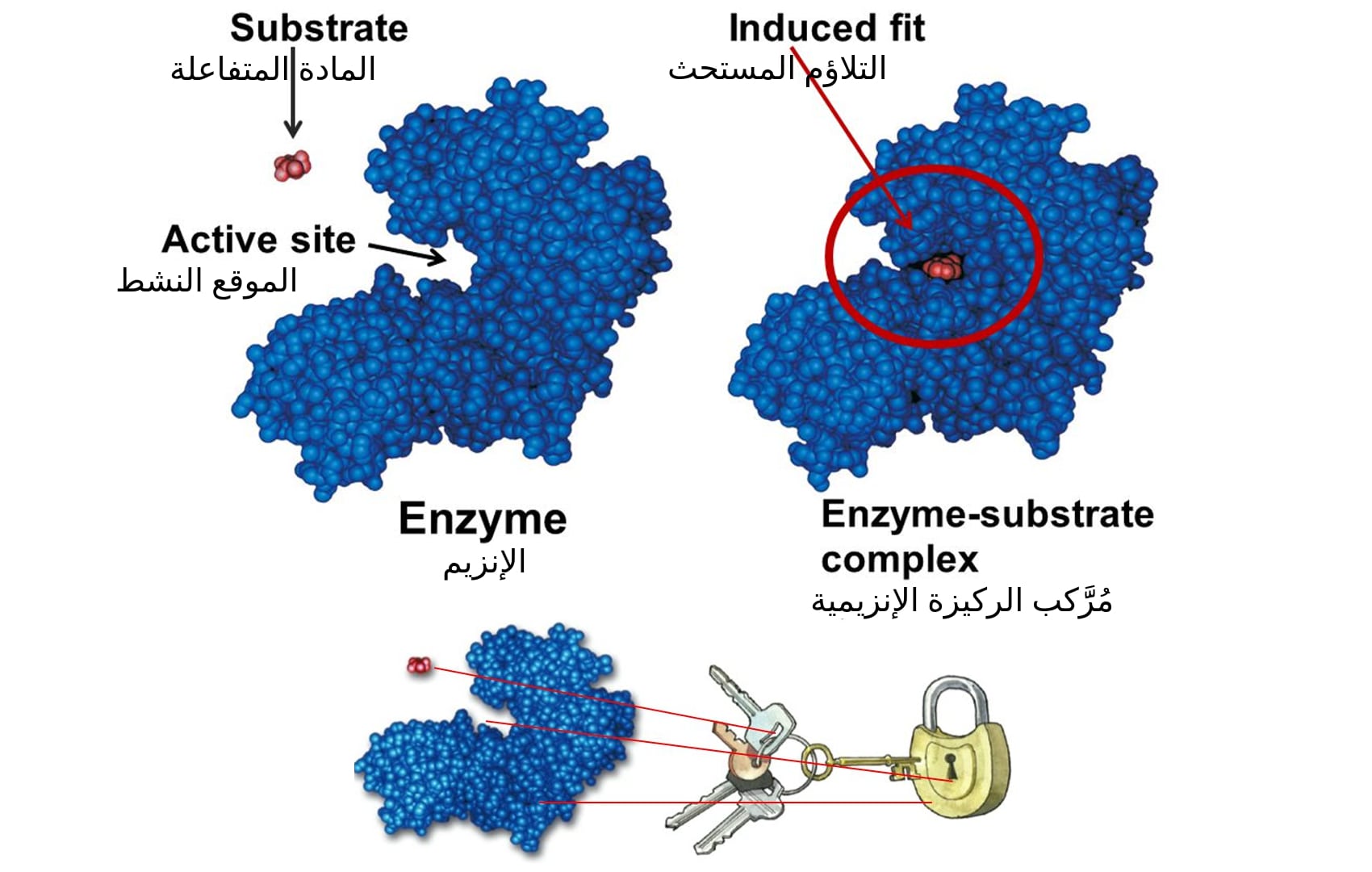
هذه الميزة الهيكلية للإنزيم هي السبب في ظهور العديد من الفرضيات كفرضية القفل والمفتاح التي توضح آلية عمل الموقع النشط.
ذلك التشبيه ناتج لأن:
- الموقع الفعال: يقوم بدور الجزء النشط الذي يتحكم في عمل الإنزيم ويعتبر هو الفتحة التي يوضع بها المفتاح.
- والمادة المتفاعلة: هي المفتاح المناسب للفتحة المناسبة، أو المادة المتفاعلة المناسبة للموقع الفعال.
- بينما الإنزيم نفسه: هو القفل الذي يضم فتحة المفتاح وعلى المفتاح ذاته.
يتم تحديد خصائص الموقع الفعال اعتمادا على ترتيب الأحماض الأمينية التي ينتج عنها سلاسل عديد الببتيد.
سلاسل عديد الببتيد: هي سلاسل قصيرة من الأحماض الأمينية المرتبطة ببعضها البعض.
الأحماض الأمينية: هي الوحدة الأساسية لتكوين البروتين.
بالنظر إلى نموذج القفل والمفتاح وما يوفره من تفاصيل حول الموقع الفعال بالإنزيمات، فيمكن رؤية أن انتقائية الموقع النشط للمادة المتفاعلة ترتبط بهندسته.
على سبيل المثال، لتنشأ الرابطة الهيدروجينية بين الإنزيم والمادة المتفاعلة، يجب أن تنشأ روابط بين الأكسجين والهيدروجين “O-H” أو روابط بين الهيدروجين والنيتروجين “N-H”.
تعتمد قوة هذا التفاعل تحديداً على الشكل الهندسي للإنزيم، لأنه يجب أن تكون الذرات قريبة بما يكفي من بعضها البعض، وفي اتجاهها الصحيح.
كما تحتاج تفاعلات الهيدروجين أن تتشكل الذرات على هيئة خط مستقيم أو شبه مستقيم، لذلك يؤثر الشكل الهندسي للإنزيم على درجة تخصصه.
الإنزيم المعدني
نظراً لوجود العديد من أنواع المواقع الفعالة داخل الإنزيم، فسيكون من الصعب طرحها جميعاً للنقاش، ولكن لنأخذ فئة واحدة مهمة من المواقع النشطة المشتملة على عوامل مرافقة من أيونات المعادن المختلفة.
تساهم الأيونات المعدنية على تنظيم الروابط التساهمية مع الأحماض الامينية، وعندما يكون المعدن مرتبطاً بإحكام بواسطة الروابط التساهمية، يُطلق على الإنزيم لقب الإنزيم المعدني “Metalloenzyme“.
لكن عندما لا يكون الارتباط تساهمياً، ينتج إنزيم منشط بالمعادن وليس أنزيم معدني، وفي كلتا الحالتين يمثل أيون المعدن دوراً مهما من تركيب الموقع الفعال بالإنزيم.
تعمل “أيونات المعادن” في المواقع النشطة بالإنزيمات على تثبيت واستقرار الشحنات السالبة للعناصر الكيميائية داخل الإنزيم.
الخلاصة
الموقع النشط بالإنزيم يعمل كمؤشر للتفاعل ولدرجة تخصص الإنزيم ويحدد المادة المتفاعلة أو المفتاح المناسب للإنزيم.
تحتوي الإنزيمات على موقع فعال واحد أو أكثر وتعلب الإنزيمات دوراً محفزاً للتفاعلات الكيميائية.
تساهم الأيونات المعدنية على تقوية الروابط الناشئة بين المواقع النشطة وبروتينات المواد المتفاعلة اعتمادا على فرضية القفل والمفتاح.
- الإنزيمات، من موقع “uobabylon.edu.iq”، تم الاطلاع عليه بتاريخ 11-9-2021.
- Active Site، من موقع “encyclopedia.com”، تم الاطلاع عليه بتاريخ 11-9-2021.