يستخدم العلماء مصطلح الطاقة الحيوية لوصف مفهوم تدفق الطاقة عبر الأنظمة الحية، مثل الخلايا (منظر 1).
تحدث العمليات داخل الخلية مثل بناء وهدم الجزيئات المعقدة من خلال تفاعلات كيميائية متدرجة، بعض هذه التفاعلات الكيميائية تلقائية مصحوبة بخروج طاقة، في حين أن البعض الآخر يحتاج إلى طاقة لإتمام العملية.
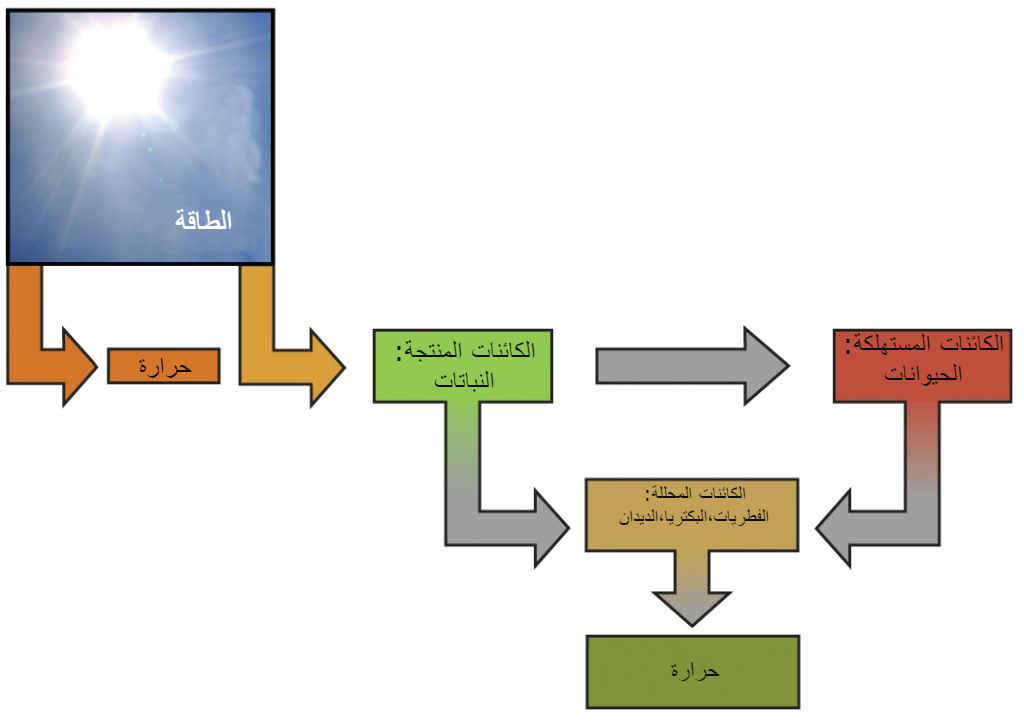
تستخدم النباتات عملية البناء الضوئي لامتصاص طاقتها من الشمس، وتأكل الحيوانات العشبية النباتات للحصول على الطاقة، بينما تتغذى الحيوانات آكلة اللحوم على الحيوانات العشبية، ويساهم التحلل النهائي للمواد النباتية والحيوانية على تجميع المغذيات في التربة (منظر 1).
تمامًا كما يجب أن تستهلك الكائنات الحية الطعام باستمرار لتجديد مواردها من الطاقة، يجب أن تنتج الخلايا باستمرار المزيد من الطاقة لتجديد تلك المستخدمة في العديد من التفاعلات الكيميائية التي تتطلبها والتي تحدث باستمرار.
يُشار إلى جميع التفاعلات الكيميائية الموجود داخل الخلايا، بما في ذلك تلك التي تستهلك أو تنتج الطاقة، على أنها عملية التمثيل الغذائي للخلية.
المسارات الأيضية
ضع في اعتبارك عملية التمثيل الغذائي للسكر، هذا مثال كلاسيكي على إحدى العمليات الخلوية العديدة التي تستخدم وتنتج الطاقة.
تستهلك الكائنات الحية السكريات كمصدر رئيسي للطاقة، لأن جزيئات السكر تحتوي على قدر كبير من الطاقة المخزنة داخل روابطها، وبالنسبة للجزء الأكبر، تنتج الكائنات الحية مثل النباتات هذه السكريات.
أثناء عملية البناء الضوئي، تستخدم النباتات الطاقة (في الأصل من ضوء الشمس) لتحويل غاز ثاني أكسيد الكربون إلى جزيئات السكر مثل الجلوكوز، يستهلكون ثاني أكسيد الكربون وينتجون الأكسجين كنفايات.
نظرًا لأن هذه العملية تتضمن تصنيع جُزيء لتخزين الطاقة، فإنها تتطلب إدخال طاقة لتتم العملية.
أثناء التفاعلات الضوئية لعملية البناء الضوئي، تختزن الطاقة من خلال جُزيء يسمى أدينوسين ثلاثي الفوسفات (ATP)، وهو عُملة الطاقة الأولية لجميع الخلايا، تمامًا كما نستخدم الدولار كعملة لشراء السلع.
تستخدم الخلايا جزيئات ATP كعملة للطاقة لأداء العمليات الحيوية.
يمكنك الإطلاع على المزيد حول (ATP) من خلال مقال مركب الطاقة أدينوسين ثلاثي الفوسفات (ATP) في الأنظمة الحية
في المقابل، تستهلك جزيئات تخزين الطاقة مثل الجلوكوز فقط لتفتيها واستخدام طاقتها.
يتلخص تفاعل استخدم طاقة جزيء السكر – في الخلايا المتطلبة للأكسجين لأجل البقاء – من خلال رد الفعل العكسي لعملية البناء الضوئي، وفي هذا التفاعل، يُستهلك الأكسجين وينطلق ثاني أكسيد الكربون كنفايات.
يتضمن كُلاً من هذين التفاعلين خطوات عديدة
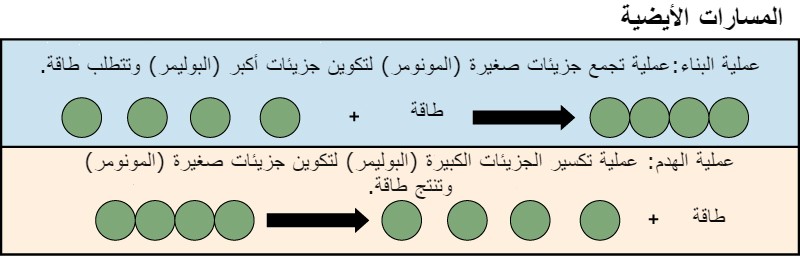
توضح عمليات بناء وهدم جزيئات السكر مثالين على مسارات التمثيل الغذائي.
المسار الأيضي عبارة عن سلسلة من التفاعلات الكيميائية التي تأخذ جزيء البدء وتعدله خطوة بخطوة، من خلال سلسلة من المواد الوسيطة الأيضية، مما يؤدي في النهاية إلى إنتاج منتج نهائي.
في مثال ايض السكر، قام المسار الأيضي الأول بتخليق السكر من جزيئات أصغر، والمسار الآخر بتحطيم السكر إلى جزيئات أصغر.
يُشار إلى هاتين العمليتين المتعارضتين بالمسارات البنائية (بناء البوليمرات) والمسارات الهدمية (تكسير البوليمرات إلى مونومراتها)، على التوالي.
وبالتالي، فإن التمثيل الغذائي يتكون من البناء والهدم (منظر 2).
كلًا من عملية الهدم والبناء مطلوبان للحفاظ على توازن طاقة الخلية.
من المهم أن تعرف أن التفاعلات الكيميائية للمسارات الأيضية لا تحدث من تلقاء نفسها.
بل تُسهل كل خطوة من خطوات التفاعل أو تُحفز بواسطة بروتين يسمى الإنزيم.
تعتبر الإنزيمات مهمة لتحفيز جميع أنواع التفاعلات البيولوجية – تلك التي تتطلب طاقة وكذلك تلك التي تطلق الطاقة.
الديناميكا الحرارية
العلم الذي يدرس خواص انتقال الشكل الحراري للطاقة وتحولاته إلى أوجه أخرى منها، يُطلق على الأمر المتعلق بحالة معينة من نقل الطاقة اسم “نظام“، ويُطلق على كل شيء خارج هذه المادة اسم “البيئة المحيطة“.
على سبيل المثال، عند تسخين قدر من الماء على الموقد، فإن النظام يشمل (الموقد والقدر والماء) وتُنقل الطاقة داخل النظام.
هناك نوعان من الأنظمة:
- أنظمة مفتوحة.
- أنظمة مغلقة.
في النظام المفتوح، يمكن تبادل كل من الطاقة والمادة مع الوسط المحيط، مثل نظام الموقد مفتوح لأن جزيئات الماء والحرارة (الآن في شكل غاز) يمكن أن تفقد في الهواء.
إذا وضعت غطاءً على إناء الماء، فإنه يصبح نظامًا مغلقًا، وفي هذا النظام المغلق، لا يمكن تبادل المادة، ولكن يمكن تبادل الطاقة.
تعد الكائنات الحية أنظمة مفتوحة. حيث تتبادل الطاقة بينهم وبين محيطهم أثناء استخدامهم للطاقة من الشمس لإجراء عملية التمثيل الضوئي أو استهلاك جزيئات تخزين الطاقة وإطلاق الطاقة إلى البيئة على هيئة الحرارة.
مثل كل الأشياء في العالم المادي، تخضع الطاقة للقوانين الفيزيائية. تتحكم قوانين الديناميكا الحرارية في نقل الطاقة داخل جميع أنظمة الكون وفيما بينها.
بشكل عام، تُعرَّف الطاقة بأنها القدرة على القيام بالعمل، أو إحداث نوع من التغيير.
توجد الطاقة بأشكال مختلفة على سبيل المثال، الطاقة الكهربائية والطاقة الضوئية والطاقة الحرارية كلها أنواع مختلفة من الطاقة.
لتقدير طريقة تدفق الطاقة داخل وخارج الأنظمة البيولوجية، من المهم فهم اثنين من القوانين الفيزيائية التي تحكم الطاقة.
القانون الأول للديناميكا الحرارية
ينص القانون الأول للديناميكا الحرارية على أن الكمية الإجمالية للطاقة في الكون ثابتة ومحفوظة؛ بعبارة أخرى، كان هناك دائمًا، وسيظل دائمًا، نفس القدر من الطاقة في الكون.
توجد الطاقة في العديد من الأشكال المختلفة وفقًا للقانون الأول للديناميكا الحرارية، يمكن نقل الطاقة من مكان إلى آخر أو تحويلها إلى أشكال مختلفة، ولكن لا يمكن إنشاؤها أو تدميرها.
تحدث عمليات نقل وتحويل الطاقة من حولنا طوال الوقت، حيث تعمل المصابيح الكهربائية على تحويل الطاقة الكهربائية إلى طاقة ضوئية وحرارية، وتقوم مواقد الغاز بتحويل الطاقة الكيميائية من الغاز الطبيعي إلى طاقة حرارية، وتقوم النباتات بأحد أكثر تحولات الطاقة المفيدة بيولوجيًا على وجه الأرض: تحويل طاقة ضوء الشمس إلى طاقة كيميائية مخزنة في الجزيئات العضوية (منظر 3).
يزود الطعام الذي نستهلكه خلايانا بالطاقة لأداء وظائف الجسم، تمامًا كما تزود الطاقة الضوئية النباتات بالوسائل اللازمة لتوليد الطاقة الكيميائية التي تحتاجها.
يتمثل التحدي الذي يواجه جميع الكائنات الحية في الحصول على الطاقة من محيطها في أشكال يمكنها نقلها أو تحويلها إلى طاقة قابلة للاستخدام للقيام بعملها، تطورت الخلايا الحية لمواجهة هذا التحدي بشكل جيد للغاية.
تتحول الطاقة الكيميائية المُخزنة داخل الجزيئات العضوية مثل السكريات والدهون عبر سلسلة من التفاعلات الكيميائية الخلوية إلى طاقة داخل جزيئات ATP.
يمكن الوصول بسهولة إلى الطاقة في جزيئات ATP للقيام بالعمل.
تتضمن الأمثلة على أنواع العمل الذي تحتاج الخلايا القيام به، بناء جزيئات معقدة، ونقل المواد، وتشغيل حركة الضرب للأهداب أو الأسواط، وتقلص ألياف العضلات لخلق الحركة، والتكاثر.
القانون الثاني للديناميكا الحرارية
قد تبدو المهام الأساسية للخلية الحية المتمثلة في الحصول على الطاقة وتحويلها واستخدامها للقيام بالعمل أمرًا بسيطًا.
ومع ذلك، فإن القانون الثاني للديناميكا الحرارية يشرح سبب كون هذه المهام أصعب مما تبدو عليه.
جميع عمليات نقل الطاقة وتحولاتها لا تكون فعالة بشكل كامل، ففي كل عملية نقل للطاقة؛ يفقد قدر من الطاقة بشكل غير قابل للاستخدام.
في معظم الحالات،يكون هذا الفقد علي هيئة طاقة حرارية، من الناحية الديناميكية الحرارية؛ تُعرَّف الطاقة الحرارية بأنها الطاقة المنقولة من مكان إلى آخر لا يعمل.
فعلى سبيل المثال؛ عند تشغيل المصباح الكهربائي،تُفقد بعض الطاقة التي تتحول من الطاقة الكهربائية إلى طاقة ضوئية كطاقة حرارية، وبالمثل تُفقد بعض الطاقة كطاقة حرارية أثناء التفاعلات الأيضية الخلوية
جربها بنفسك
قم بإعداد تجربة بسيطة لفهم كيفية نقل الطاقة وكيفية التغيير في نتائج القصور الحراري “entropy“.
- خذ قطعة من الثلج، هذا ماء في صورة صلبة،لذلك له ترتيب بنيوي عالٍ؛ هذا يعني أن الجزيئات لا يمكن أن تتحرك كثيرًا وهي في وضع ثابت درجة حرارة الجليد تكون صفر درجة مئوية ونتيجة لذلك، فإن القصور الحراري “entropy” النظام منخفضة.
- اترك الثلج يذوب في درجة حرارة الغرفة ما هي حالة الجزيئات الموجودة في الماء السائل الآن؟ كيف تم نقل الطاقة؟ هل القصور الحراري للنظام أعلى أم أدنى؟ لماذا ؟
- سخن الماء حتى درجة الغليان. ماذا يحدث للقصور الحراري للنظام عند تسخين الماء؟
من المفاهيم المهمة في الأنظمة الفيزيائية هو مفهوم النظام والفوضى.
كلما زادت الطاقة التي يفقدها النظام إلى المناطق المحيطة به، كلما كان النظام أقل ترتيبًا وأكثر عشوائية.
يشير العلماء إلى مقياس العشوائية أو الفوضى داخل نظام ما على أنه انتروبيا.
الانتروبيا العالية تعني الفوضى العالية والطاقة المنخفضة.
الجزيئات والتفاعلات الكيميائية لها إنتروبيا متفاوتة أيضًا، على سبيل المثال، الإنتروبيا تزداد عندما تنتشر الجزيئات عند تركيز عالٍ في مكان واحد وتنتشر.
ينص القانون الثاني للديناميكا الحرارية على أن الطاقة ستُفقد دائمًا بسبب نقل الحرارة أو التحولات.
تُراتب الكائنات الحية بدرجة عالية، وتتطلب مدخلات طاقة ثابتة يتم الحفاظ عليها في حالة انخفاض الانتروبيا.
الطاقة
طاقة الوضع وطاقة الحركة
عندما يكون جسم ما في حالة حركة، فهناك طاقة مرتبطة بذلك الجسم فكر في كرة هدم حتى كرة التدمير البطيئة يمكن أن تسبب ضررًا كبيرًا للأجسام الأخرى.
تسمى الطاقة المرتبطة بالأشياء المتحركة بالطاقة الحركية (منظر4)، الرصاصة المسرعة، والشخص الذي يمشي، والحركة السريعة للجزيئات في الهواء (التي تنتج الحرارة) كلهالها طاقة حركية.

الآن ماذا لو رفعت نفس كرة التحطيم الثابتة طابقين فوق الأرض باستخدام رافعة؟ إذا كانت كرة التحطيم المعلقة ثابتة، فهل هناك طاقة مرتبطة بها؟ الجواب نعم.
الطاقة اللازمة لرفع كرة التحطيم لم تختف، لكنها مخزنة الآن في الكرة بحكم موقعها وقوة الجاذبية المؤثرة عليها، هذا النوع من الطاقة يسمى طاقة الوضع (منظر 4).
إذا سقطت الكرة، فإن طاقة الوضع ستتحول إلى طاقة حركية إلى أن تستنزف كل طاقة الوضع عندما تستقر الكرة على الأرض.
تتأرجح كرات التحطيم أيضًا مثل البندول من خلال التأرجح، هناك تغير مستمر في طاقة الوضع (الأعلى في الجزء العلوي من التأرجح) إلى الطاقة الحركية (الأعلى في الجزء السفلي من التأرجح)، ومن الأمثلة الأخرى لطاقة الوضع، طاقة الماء الموجودة خلف السد أو شخص على وشك القفز بالمظلة من طائرة.
طاقة الوضع وبنية المادة
لا ترتبط طاقة الوضع فقط بموقع المادة، ولكن أيضًا ببنية المادة، فالهواء الموجود على الأرض لديه طاقة وضع إذا ضُغطت؛ وكذلك الرباط المطاطي المشدود،على المستوى الجزيئي، توجد الروابط التي تربط ذرات الجزيئات معًا في بنية معينة لها طاقة وضع.
تذكر أن العمليات البنائية الخلوية تتطلب طاقة لتصنيع جزيئات معقدة من جزيئات أبسط، كما أن عمليات الهدم تطلق الطاقة عندما تتكسر الجزيئات المعقدة.
حقيقة أن الطاقة يمكن إطلاقها من خلال تكسير روابط كيميائية معينة تشير إلى أن تلك الروابط لديها طاقة وضع. في الواقع، هناك طاقة وضع مخزنة داخل روابط جميع جزيئات الطعام التي نأكلها، والتي يتم تسخيرها في النهاية للاستخدام، وذلك لأن هذه الروابط يمكن أن تطلق الطاقة عند كسرها.
يُطلق على نوع طاقة الوضع الموجودة داخل الروابط الكيميائية، والتي تنطلق عندما تنكسر تلك الروابط، “بالطاقة الكيميائية“، وهي المسؤولة عن تزويد الخلايا الحية بالطاقة من الغذاء، ويحدث إطلاق الطاقة عندما تنكسر الروابط الجزيئية داخل جزيئات الطعام.
الطاقة الحرة وطاقة التنشيط
بعد معرفة أن التفاعلات الكيميائية تطلق الطاقة عندما تنكسر روابط تخزين الطاقة، فإن السؤال التالي المهم هو ما يلي: كيف يتم قياس الطاقة المرتبطة بهذه التفاعلات الكيميائية كميًا والتعبير عنها؟ كيف يمكن مقارنة الطاقة المنبعثة من تفاعل واحد مع طاقة تفاعل آخر؟
يتم استخدام قياس الطاقة الحرة لتحديد عمليات نقل الطاقة هذه. تذكر أنه وفقًا للقانون الثاني للديناميكا الحرارية، تتضمن جميع عمليات نقل الطاقة فقدان قدر من الطاقة في صورة غير قابلة للاستخدام مثل الحرارة.
تشير الطاقة الحرة على وجه التحديد إلى الطاقة المرتبطة بالتفاعل الكيميائي الذي يتوفر بعد حساب الخسائر. بعبارة أخرى، الطاقة الحرة هي طاقة قابلة للاستخدام، أو طاقة متاحة للقيام بالعمل.
إذا تم إطلاق الطاقة أثناء تفاعل كيميائي، فإن التغيير في الطاقة الحرة، والمشار إليه بـ ∆G (دلتا G) سيكون رقمًا سالبًا. التغيير السلبي في الطاقة الحرة يعني أيضًا أن منتجات التفاعل لها طاقة حرة أقل من المواد المتفاعلة، لأنها تطلق بعض الطاقة الحرة أثناء التفاعل.
التفاعلات التي لها تغير سلبي في الطاقة الحرة وبالتالي تطلق الطاقة الحرة تسمى التفاعلات مطلقة للطاقة.
فكر: مطلق للطاقة(exergonic) تعني أن الطاقة تخرج من النظام.
يُشار إلى هذه التفاعلات أيضًا باسم التفاعلات التلقائية، طاقة النواتج أقل من طاقة المواد المتفاعلة.
يجب التمييز بين المصطلح تلقائي وفكرة حدوث تفاعل كيميائي على الفور. على عكس الاستخدام اليومي للمصطلح، فإن التفاعل التلقائي ليس رد فعل يحدث فجأة أو بسرعة. صدأ الحديد هو مثال تفاعل تلقائي يحدث ببطء، شيئًا فشيئًا، بمرور الوقت.
إذا قام تفاعل كيميائي بامتصاص الطاقة بدلاً من إطلاق الطاقة بشكل متوازن، فإن ∆G لهذا التفاعل سيكون قيمة موجبة. في هذه الحالة، نواتج التفاعل لديها طاقة حرة أكثر من المواد المتفاعلة. وبالتالي، يمكن اعتبار نواتج هذه التفاعلات جزيئات تخزين الطاقة.
تسمى هذه التفاعلات الكيميائية تفاعلات ماصة للطاقة “endergonic” وهي غير تلقائية. لن يحدث تفاعل مائي من تلقاء نفسه بدون إضافة طاقة حرة.
هناك مفهوم آخر مهم يجب مراعاته فيما يتعلق بالتفاعلات الي تطلق طاقة:
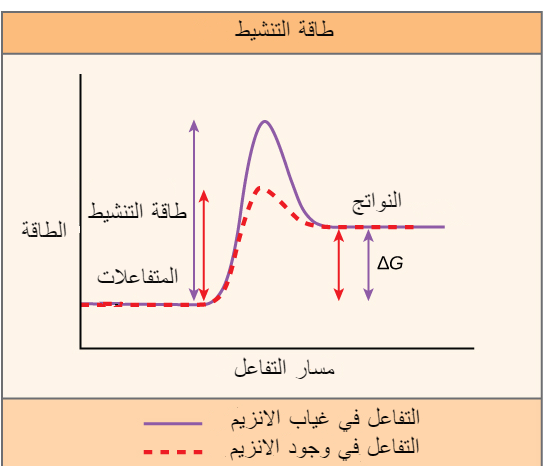
تتطلب التفاعلات المطلقة للطاقة قدرًا صغيرًا من الطاقة للبدء، قبل أن تتمكن من المضي قدمًا في خطوات إطلاق الطاقة.هذه التفاعلات لها إطلاق صافٍ للطاقة، لكنها لا تزال تتطلب بعض مدخلات الطاقة في البداية. هذه الكمية الصغيرة من مدخلات الطاقة اللازمة لحدوث جميع التفاعلات الكيميائية تسمى طاقة التنشيط.
الانزيمات
تسمى المادة التي تساعد في حدوث تفاعل كيميائي محفزًا، وتسمى الجزيئات التي تحفز التفاعلات الكيميائية الحيوية بالإنزيمات.
معظم الإنزيمات عبارة عن بروتينات وتؤدي المهمة الحاسمة المتمثلة في خفض طاقات التنشيط للتفاعلات الكيميائية داخل الخلية.
تحدث معظم التفاعلات الحرجة للخلية الحية ببطء شديد في درجات الحرارة العادية بحيث لا تكون ذات فائدة للخلية. بدون إنزيمات لتسريع ردود الفعل هذه، لا يمكن للحياة أن تستمر.
تقوم الإنزيمات بذلك عن طريق الارتباط بجزيئات المتفاعلة وتثبيتها بطريقة تجعل عمليات تكسير وتشكيل الروابط الكيميائية تتم بسهولة أكبر.
من المهم أن تتذكر أن الإنزيمات لا تتغير سواء كان التفاعل طاردًا للطاقة أو ماصًا لها. هذا لأنها لا تغير الطاقة الحرة للمواد المتفاعلة أو النواتج. فهي تقلل فقط من طاقة التنشيط المطلوبة للتفاعل للمضي قدمًا (منظر 5).
بالإضافة إلى ذلك، لا يتغير الإنزيم نفسه بالتفاعل الذي يحفزه. فبمجردتحفيز تفاعل واحد، يكون الإنزيم قادرًا على المشاركة في تفاعلات أخرى.
المواد المتفاعلة الكيميائية التي يرتبط بها الإنزيم تسمى ركائز الإنزيم. قد يكون هناك ركيزة واحدة أو أكثر، اعتمادًا على تفاعل كيميائي معين. في بعض التفاعلات، يتم تقسيم الركيزة المتفاعلة الواحدة إلى منتجات متعددة، وفي حالات أخرى، قد تتحد ركيزتان لتكوين جزيء أكبر. قد يدخل متفاعلان أيضًا في التفاعل ويتم تعديل كلاهما، ولكنهما يخرجان من التفاعل كناتجين.
يُطلق على الموقع الموجود داخل الإنزيم حيث ترتبط الركيزة الموقع النشط للإنزيم. الموقع النشط هو حيث يحدث “التفاعل”.
نظرًا لأن الإنزيمات عبارة عن بروتينات، فهناك مجموعة فريدة من سلاسل الأحماض الأمينية الجانبية داخل الموقع النشط. كل سلسلة جانبية تتميز بخصائص مختلفة؛ يمكن أن تكون كبيرة أو صغيرة، حمضية أو قاعدية ضعيفة، محبة للماء أو كارهة للماء، موجبة أو سالبة الشحنة، أو محايدة.
المزيج الفريد من السلاسل الجانبية يخلق بيئة كيميائية محددة للغاية داخل الموقع النشط. هذه البيئة المحددة مناسبة للارتباط بركيزة كيميائية محددة (أو ركائز).
تخضع المواقع النشطة لتأثيرات البيئة المحلية؛ تؤدي زيادة درجة الحرارة البيئية بشكل عام إلى زيادة معدلات التفاعل، المُحفز بالإنزيم أو غيره.
ومع ذلك، فإن درجات الحرارة خارج النطاق الأمثل تقلل من معدل تحفيز الإنزيم على التفاعل؛ستؤدي درجات الحرارة الساخنة في النهاية إلى تغيير طبيعة الإنزيمات، وهو تغيير لا رجعة فيه في الشكل ثلاثي الأبعاد وبالتالي وظيفة الإنزيم.
الإنزيمات مناسبة أيضًا للعمل بشكل أفضل ضمن نطاق تركيز درجة حموضة وملح معين، وكما هو الحال مع درجة الحرارة، يمكن أن تتسبب تركيزات الأس الهيدروجيني والملح الشديدة في تغيير طبيعة الإنزيمات.
لسنوات عديدة، اعتقد العلماء أن ارتباط الركيزة الإنزيمية يحدث بطريقة “القفل والمفتاح” البسيطة. أكد هذا النموذج أن الإنزيم والركيزة يتناسبان معًا بشكل مثالي في خطوة واحدة فورية. ومع ذلك، فإن البحث الحالي يدعم نموذجًا يسمى الملاءمة المستحثة (منظر 6).
يتوسع نموذج الملاءمة المستحثة في نموذج القفل والمفتاح من خلال ارتباط أكثر ديناميكية بين الإنزيم والركيزة؛ عندما يجتمع الإنزيم والركيزة معًا، يتسبب تفاعلهما في حدوث تحول طفيف في بنية الإنزيم التي تشكل ترتيب ارتباط مثالي بين الإنزيم والركيزة.
عندما يربط الإنزيم ركائزه، يتم تكوين مركب ركيزة إنزيم؛ هذا المركب يقلل من طاقة التنشيط للتفاعل ويعزز تقدمه السريع بإحدى الطرق المتعددة الممكنة.
على المستوى الأساسي، تعزز الإنزيمات التفاعلات الكيميائية التي تتضمن أكثر من ركيزة واحدة عن طريق تجميع الركائز معًا في الاتجاه الأمثل للتفاعل.
الطريقة الأخرى التي تعمل بها الإنزيمات على تعزيز تفاعل ركائزها هي خلق بيئة مثالية داخل الموقع النشط لحدوث التفاعل.

الانتقال لزيادة تقارب الركيزة للموقع النشط.
نموذج الملاءمة المستحثة: تعديل لنموذج القفل والمفتاح ويشرح كيف تخضع الإنزيمات والركائز لتعديلات ديناميكية أثناء حالة الانتقال لزيادة تقارب الركيزة للموقع النشط.
في الوظائف: تطوير الأدوية الصيدلانية
الإنزيمات هي المكونات الرئيسية لمسارات التمثيل الغذائي، يعد فهم كيفية عمل الإنزيمات وكيفية تنظيمها من المبادئ الأساسية وراء تطوير العديد من الأدوية الصيدلانية الموجودة في السوق اليوم.يتعاون علماء الأحياء الذين يعملون في هذا المجال مع علماء آخرين لتصميم الأدوية.
ضع في اعتبارك العقاقير المخفضة للكوليسترول على سبيل المثال – “الستاتين” هو الاسم الذي يطلق على فئة واحدة من الأدوية التي يمكن أن تقلل من مستويات الكوليسترول؛هذه المركبات هي مثبطات لإنزيم اختزال HMG-CoA ، وهو الإنزيم الذي يصنع الكوليسترول من الدهون في الجسم.
عن طريق تثبيط هذا الإنزيم، يمكن خفض مستوى الكوليسترول الذي يتم تصنيعه في الجسم.
وبالمثل، فإن عقار “الأسيتامينوفين”، الذي يتم تسويقه بشكل شائع تحت الاسم التجاري “تايلينول”، هو مثبط لإنزيم إنزيم الأكسدة الحلقية “cyclooxygenase”. في حين أنه يستخدم للتخفيف من الحمى والالتهاب (الألم)، إلا أن آلية عمله لا تزال غير مفهومة تمامًا.

كيف يتم اكتشاف الأدوية؟ أحد أكبر التحديات في اكتشاف الأدوية هو تحديد الهدف الدوائي. الهدف الدوائي هو الجزيء الذي هو حرفيًا هدف الدواء. في حالة العقاقير المخفضة للكوليسترول، فإن اختزال HMG-CoA هو الهدف الدوائي.
يتم تحديد الأهداف الدوائية من خلال بحث مضني في المختبر. لا يكفي تحديد الهدف وحده؛ يحتاج العلماء أيضًا إلى معرفة كيفية عمل الهدف داخل الخلية وأي تفاعلات تنحرف في حالة المرض.
بمجرد تحديد الهدف والمسار، تبدأ العملية الفعلية لتصميم الدواء؛ في هذه المرحلة، يعمل الكيميائيون وعلماء الأحياء معًا لتصميم وتوليف الجزيئات التي يمكن أن تمنع أو تنشط تفاعلًا معينًا.
ومع ذلك، فهذه ليست سوى البداية: إذا وعندما ينجح نموذج أولي للدواء في أداء وظيفته، فإنه يخضع للعديد من الاختبارات من التجارب المخبرية إلى التجارب السريرية قبل أن يحصل على موافقة من إدارة الغذاء والدواء الأمريكية ليتم عرضه السوق.
العديد من الإنزيمات لا تعمل على النحو الأمثل، أو حتى على الإطلاق، ما لم تكن مرتبطة بجزيئات مساعدة أخرى غير بروتينية. قد تترابط إما مؤقتًا من خلال روابط أيونية أو هيدروجينية، أو بشكل دائم من خلال روابط تساهمية أقوى.
يؤدي الارتباط بهذه الجزيئات إلى تعزيز الشكل والوظيفة الأمثل للأنزيمات الخاصة بكل منها؛ ومن الأمثلة على هذه الأنواع من الجزيئات المساعدة العوامل المساعدة والإنزيمات المساعدة.
العوامل المساعدة هي أيونات غير عضوية مثل أيونات الحديد والمغنيسيوم، الإنزيمات المساعدة هي جزيئات عضوية مساعدة؛ تلك التي لها بنية ذرية أساسية تتكون من الكربون والهيدروجين.
الخلاصة
- تؤدي الخلايا وظائف الحياة من خلال التفاعلات الكيميائية المختلفة، يشير التمثيل الغذائي للخلية إلى مجموعة من التفاعلات الكيميائية التي تحدث داخلها.
- تعمل عمليات الهدم على تفكيك المواد الكيميائية المعقدة إلى مواد أبسط وترتبط بإطلاق الطاقة. تبني عمليات البناء جزيئات معقدة من الجزيئات الأبسط وتتطلب طاقة.
- في دراسة الطاقة، يشير مصطلح النظام إلى المادة والبيئة التي تشارك في عمليات نقل الطاقة، الانتروبيا هو مقياس لاضطراب النظام.
- القوانين الفيزيائية التي تصف نقل الطاقة هي قوانين الديناميكا الحرارية؛ينص القانون الأول على أن إجمالي كمية الطاقة في الكون ثابت. ينص القانون الثاني للديناميكا الحرارية على أن كل عملية نقل للطاقة تنطوي على بعض فقدان الطاقة في صورة غير صالحة للاستعمال، مثل الطاقة الحرارية.
- تأتي الطاقة بأشكال مختلفة: طاقة حركة وطاقة وضع وطاقة حرة. يمكن أن يكون التغيير في الطاقة الحرة للتفاعل سلبيًا (يطلق طاقة، طاردًا للطاقة) أو إيجابيًا (يستهلك طاقة، منشط الطاقة).
- تتطلب جميع التفاعلات مدخلاً أوليًا للطاقة لتستمر، يُطلق عليه طاقة التنشيط.
- الإنزيمات عبارة عن محفزات كيميائية تعمل على تسريع التفاعلات الكيميائية عن طريق خفض طاقة التنشيط الخاصة بها.
- تمتلك الإنزيمات موقعًا نشطًا مع بيئة كيميائية فريدة تناسب تفاعلات كيميائية معينة لذلك الإنزيم، والتي تسمى الركائز.
- يُعتقد أن الإنزيمات والركائز ترتبط وفقًا لنموذج الملاءمة المستحثة.
- يعمل الإنزيم للحفاظ على الموارد والاستجابة للبيئة بشكل مثالي.