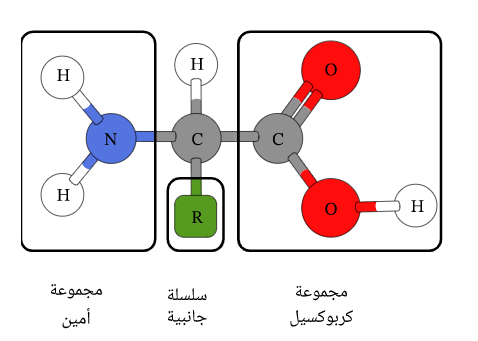
البروتين عبارة عن بوليمرات من الأحماض الأمينية المحتوية على ذرة كربون مركزية وهيدروجين ومجموعة كربوكسيل مع مجموعة أمينية وسلسلة جانبية متغيرة تُسمى مجموعة R.
المجموعة R مسؤولة عن تحديد نوع الأحماض الأمينية المكونة للبروتين، وتنقسم تلك المجموعة إلى:
- السلاسل الجانبية المُحبة للماء المشحونة كهربائيًا.
- السلاسل الجانبية القطبية، ولكن غير مشحونة.
- السلاسل الجانبية غير القطبية الكارهة للماء.
ماذا ستعلم؟
-التعرف على مكونات البروتين. -تحديد الطبقات المختلفة لبنية البروتين. -وضوح الوظائف الرئيسية المتعددة للبروتينات.
مستويات تركيب البروتين
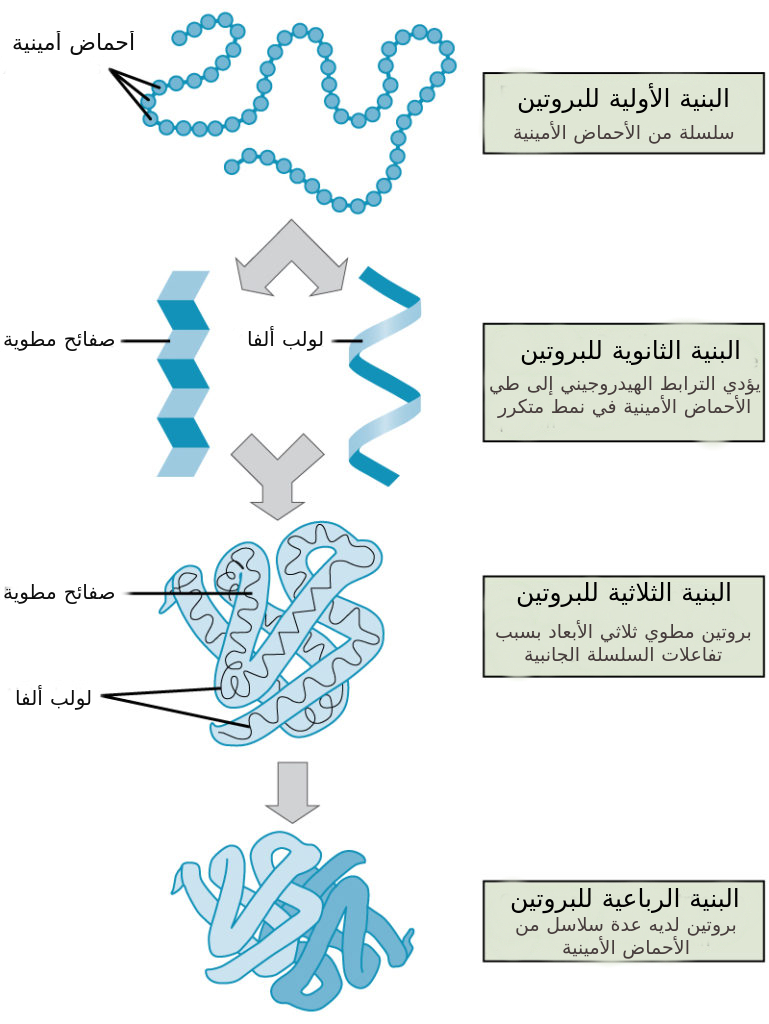
تحتوي البروتينات على طبقات مختلفة من التركيب:
- الأولي.
- الثانوي.
- الثلاثي.
- الرباعي.
تركيب البروتينات
البروتينات واحدة من أكثر الجزيئات العضوية وفرة في الأنظمة الحية، وأكثر الجزيئات الحيوية الكبيرة التي تمتلك تنوع وظيفي شاسع.
لدى البروتينات دور هيكلي، تنظيمي، انقباضي أو وقائي، ويمكنها العمل في النقل، التخزين، التواجد كأغشية أو حتى تكوين سموم وإنزيمات.
تحتوي كل خلية على آلاف البروتينات المختلفة، ولكل منها وظيفته الفريدة، ويختلفون في هياكلهم ووظائفهم، ومع ذلك فالبروتينات جميعها عبارة عن بوليمرات من أحماض أمينية مرتبة ومرتبطة معاً في تسلسل خطي.
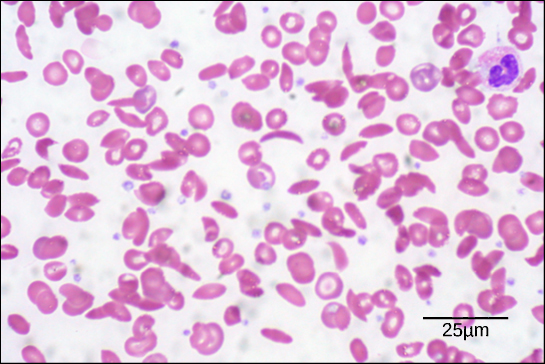
للبروتينات أشكال وأوزان جزيئية مختلفة، فبعض البروتينات كروية الشكل بينما البعض الآخر ليفي بطبيعته، فمثلا الهيموغلوبين بروتين كروي في خلايا الدم الحمراء (منظر 3)، بينما الكولاجين الموجود في بشرتنا بروتين ليفي.
فمن المهم إدراك أن شكل البروتين أمر بالغ الأهمية لوظيفته.
يؤدي التغير في درجة الحرارة ودرجة الحموضة والتعرض للمواد الكيميائية إلى تغييرات دائمة في شكل البروتين وخصائصه، مما يؤدي إلى فقدان وظيفته أو فساده.
كما تتكون جميع البروتينات من 20 نوعًا من الأحماض الأمينية مرتبين بطرق مختلفة تمامًا مثل ترتيب 9 أرقام من صفر إلى تسعة بطرق مختلفة لإعطاء أرقام هواتف لا يتطابق أياً منها مع الآخر.
يحتوي كل حمض أميني على نفس البنية الأساسية، والتي تتكون من ذرة كربون مركزية مرتبطة بمجموعة أمينية “NH2-“، ومجموعة كربوكسيل “COOH-“، وذرة هيدروجين، وذرة أخرى متغيرة أو مجموعة ذرات معروفين باسم (مجموعة R)، وهي الاختلاف الوحيد في التركيب بين العشرين حمض أميني.
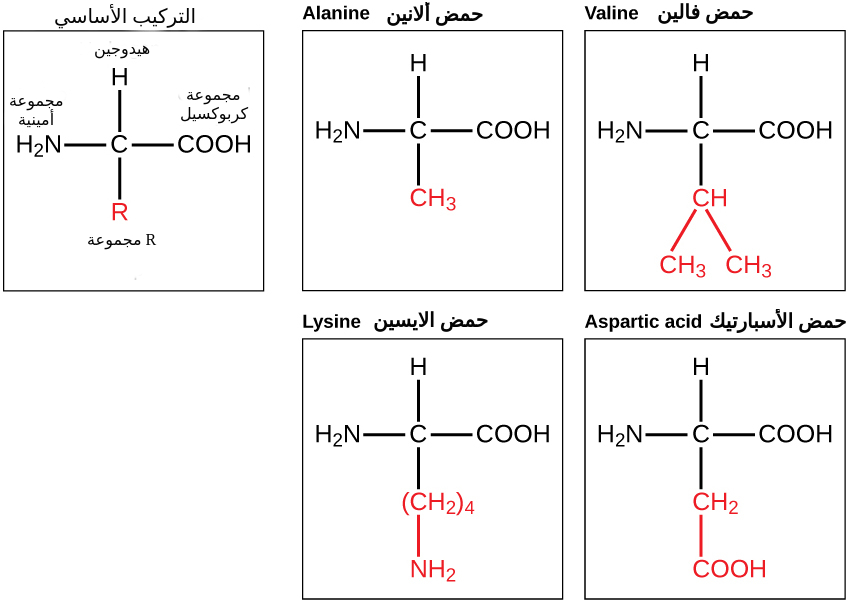
وعند تحديد الطبيعة الكيميائية للمجموعة R، يمكن تحديد الطبيعة الكيميائية للحمض الأميني الموجود داخل البروتين (ما إذا كان حمضيًا، قطبيًا أم غير قطبي)، كما يعتمد شكل البروتين وحجمه ووظيفته على ترتيب وعدد الأحماض الأمينية.
يرتبط كل حمض أميني بحمض أميني آخر برابطة تساهمية، تُعرف باسم الرابطة الببتيدية التي تتكون من تفاعل نزع الماء (البلمهة).
وظائف البروتينات
لدى البروتينات مجموعة متنوعة من الوظائف داخل الخلايا، حيث تشمل الوظائف الرئيسية العمل:
- كإنزيمات
- مستقبلات
- جزيئات نقل
- تنظيم جيني
فالإنزيمات محفزات حيوية تٌسرّع التفاعل الكيميائي دون أن تتغير بشكل دائم، ولديها مناطق نشطة لترتبط بالمادة المتفاعلة لتنشيطها أو تثبيطها.
| النوع | مثال | وظيفته |
| إنزيمات الجهاز الهضمي | الأميليز، الليبيز، البيبسين، التربسين | تساعد في هضم الطعام عن طريق تفتيت العناصر الغذائية إلى جزيئاتها الأحادية |
| نقل | الهيموغلوبين واللمف | حمّل المواد في الدم أو في سائل اللمف الحيوي داخل جميع أنحاء الجسم |
| التدعيم | الأكتين، توبولين والكيراتين | بناء هياكل مختلفة مثل الهيكل الخلوي |
| هرمونات | الأنسولين، هرمون الغدة الدرقية | تنسيق نشاط أجهزة الجسم |
| الحماية | الغلوبولين المناعي | يحمي الجسم من مسببات الأمراض الخارجية |
| الانقباضات | الأكتين والميوسين | انقباض وانبساط العضلات وحركة الجسم |
| التخزين | بروتينات مخزنة في البقوليات وبياض البيض (الألبومين) | توفير التغذية في المراحل المبكرة لنموا الجنين والشتلات |