بينما كان يعمل الكيميائيون في الماضي لتنقية المواد الخام واكتشاف عناصر كيميائية جديدة، أدركوا وجود عناصر مختلفة يمكن جمعها معًا تبعًا لسلوكها الكيميائي.
فقد وجدوا العديد من الصفات المتشابه بين مجموعات من العناصر الكيميائية مثل توصيل العنصر للحرارة والتيار الكهربي، درجة لمعان العنصر، حجمه، درجة غليانه، وانصهاره وغيرها من الخواص الفيزيائية والكيميائية المشتركة.
أدى هذا التشابه في الصفات إلى ترتيب العناصر الكيميائية تبعًا لهذه الصفات فيما عُرف بعد ذلك بـ الجدول الدوري الحديث للعناصر الكيميائية، فما هو هذا الجدول؟
ما هو الجدول الدوري
يعتبر الجدول الدوري للعناصر الكيميائية من أهم الأدوات المستخدمة في مجال الكيمياء، حيث يعكس ترتيبًا منظمًا للعناصر الكيميائية وفقًا لخواصها الفيزيائية والكيميائية، ويوفر نظرة شاملة عن تنظيم العناصر وعلاقاتها المتبادلة.
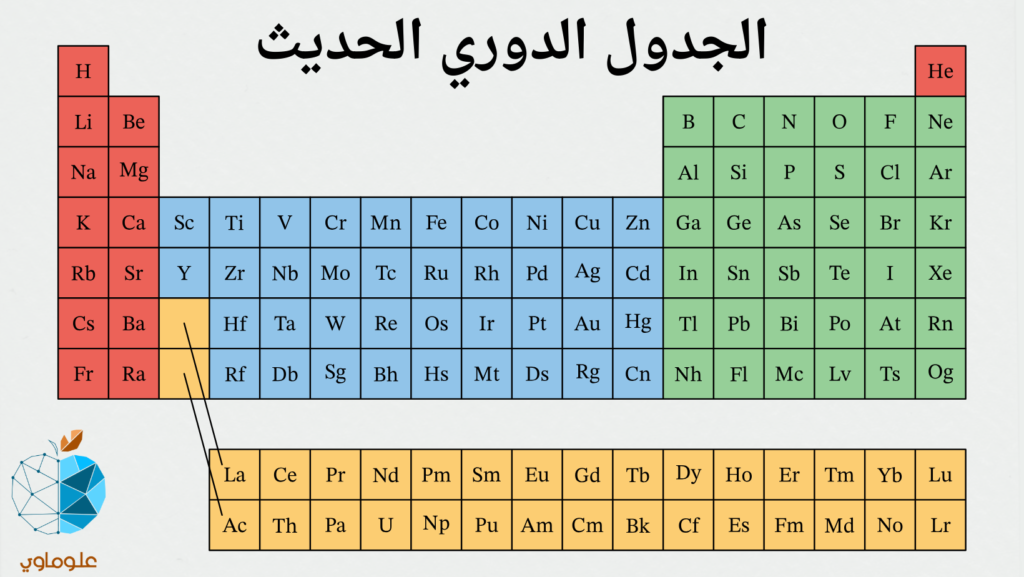
يعرف الجدول الدوري بأنّه: جدول بياني مُنظم يحتوي على جميع العناصر الكيميائية المعروفة حتى وقتنا الحاضر، حيث تكون هذه العناصر مُرتبة فيه حسب زيادة عددها الذري من اليسار إلى اليمين ومن الأعلى إلى الأسفل.
نبذة تاريخية عن نشأة الجدول الدوري
دائمًا ما بحث الكيميائيون عن طرق لترتيب العناصر الكيميائية تعكس أوجه التشابه بين خصائصها، فالجدول الدوري الحديث يسرد العناصر حسب زيادة العدد الذري (عدد البروتونات في نواة الذرة) ومع ذلك، فإن التاريخ يوضح لنا استخدام بعض العلماء للكتل الذرية النسبية لتنظيم العناصر.
ويرجع ذلك أساسًا إلى عدم تطوير فكرة أن الذرات تتكون من جسيمات دون ذرية أصغر (البروتونات والنيوترونات والإلكترونات).
ومع ذلك، فإن أساس الجدول الدوري الحديث كان راسخًا، بل واستخدم للتنبؤ بخصائص العناصر غير المكتشفة قبل وقت طويل من تطوير مفهوم العدد الذري.
من المتعارف علية عند البعض أن العالم الروسي دميتري مندليف هو أول من وضع أساس الجدول الدوري، ولكن يبقى السؤال هل كان مندليف أول من صنف العناصر؟ للإجابة على هذا السؤال يجب علينا رصد المحاولات السابقة والتعرف عليها بشيء من التفصيل.
كان هناك العديد من الكيميائيين الآخرين قبل مندليف يدرسون أنماطًا في خواص العناصر التي كانت معروفة في ذلك الوقت.
ومن بين هؤلاء أنطوان لافوازييه وهو كيميائي فرنسي بارز وشخصية رائدة في الثورة الكيميائية في القرن الثامن عشر وهو صاحب أول محاولة لتصنيف العناصر في عام 1789، فقد جمع العناصر بناءً على خصائصها إلى غازات، لافلزات، معادن وأتربة.
جاء من بعده الكيميائي الألماني يوهان دوبرينر والذي اكتشف في عام 1829 مجموعة ثلاثية من العناصر ذات خواص كيميائية متشابهة مثل الليثيوم، الصوديوم والبوتاسيوم، وأظهر إمكانية التنبؤ بخصائص العنصر الأوسط من خلال خصائص العنصرين الآخرين.
المجموعة الثانية تتضمن الكالسيوم، السترونشيوم والباريوم؛ تتميز هذه العناصر أيضًا باللمعان والتوصيل الجيد للحرارة والكهرباء، ولديها خواص كيميائية مشتركة.
إلا أن الخواص المميزة لهاتين المجموعتين كانت مختلفة بشكل ملحوظ فعلى سبيل المثال: الليثيوم والصوديوم والبوتاسيوم لديهم قابلية للتفاعل أكثر من الكالسيوم والسترونشيوم والباريوم، وأيضًا تكوّن مركبات مع الأكسجين بحيث تكون النسبة ذرتين من هذه العناصر إلى ذرة من عنصر الأكسجين.
في حين أن الكالسيوم والسترونشيوم والباريوم تكون مركبات مع الأكسجين بنسبة واحد من ذرات هذه العناصر إلى واحد من ذره الأكسجين.
تظهر عناصر الفلور، الكلور، البروم واليود أيضًا خواص مشابهة لبعضها البعض، ولكن هذه الخواص شديدة الاختلاف عن خواص العناصر المذكورة بالأعلى.
ديميتري مندليف ( 1869) في روسيا و لوثر ماير في ألمانيا (1870) أدركا بصورة مستقلة وجود علاقة دورية بين خواص العناصر المعروفة في ذلك الوقت، (كلا الجدولين المنشورين يضمان العناصر مرتبة تبعًا لزيادة الكتلة الذرية).
ولكن مندليف تقدم خطوة عن ماير؛ حيث استخدم جدوله للتوقع بوجود عناصر سيكون لها خصائص مشابهة للألمونيوم والسيليكون، والتي لم تكن معروفة بعد (أُكتشف فيما بعد عنصري الغاليوم و الجرمانيوم فكان هذا الاكتشاف بمثابة دعم عظيم لعمل مندليف).
وعلى الرغم من أن مندليف وماير كانا في نزاع طويل على الأفضلية؛ إلا أن إسهامات مندليف في تطوير الجدول الدوري معروفة على نطاق أوسع الآن.
بحلول القرن العشرين أصبح من الظاهر أن العلاقة الدورية تشمل الأعداد الذرية بدلًا من الكتل الذرية، فكان التغيير الحديث لهذه العلاقة هو القانون الدوري الذي ينص على الآتي: خواص العناصر هي وظائف دورية لأعدادها الذرية.
تصنيف الجدول الدوري الحديث
تُرتب العناصر في الجدول الدوري الحديث ترتيبًا تصاعديًا تبعًا لأعدادها الذرية، وتجمع الذرات ذات الخواص المتشابهة في نفس العمود الرأسي بحيث يمثل كل عنصر، ويحتوي على عدده الذري ورمزه، متوسط كتلته الذرية، وفي بعض الأحيان اسمه.
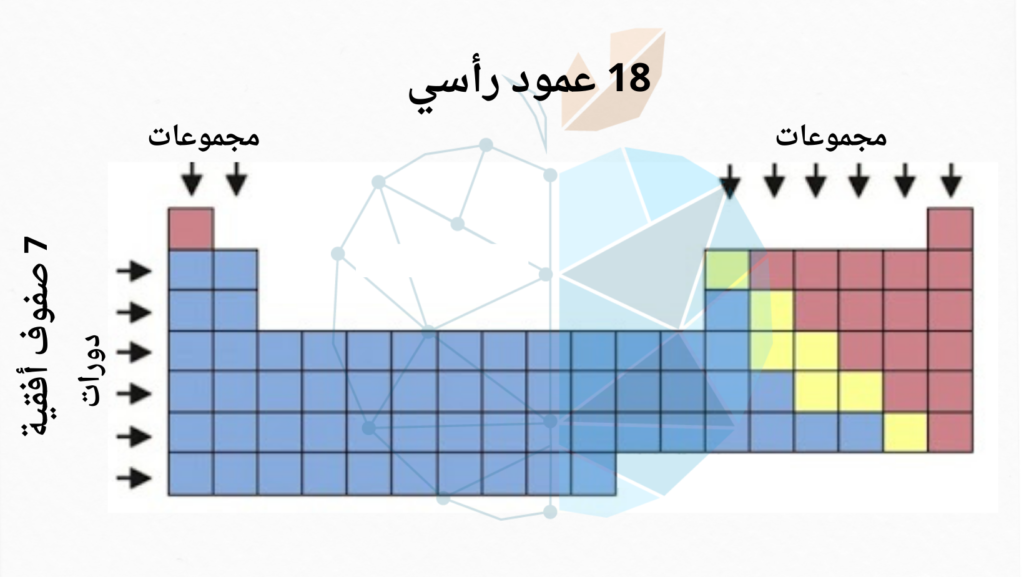
يتكون الجدول الدوري الحديث من 7 صفوف أفقية تسمى دورات، و 18 عمود رأسي يطلق عليها مجموعات، تحتوي العناصر الموجودة في نفس المجموعة على نفس عدد إلكترونات التكافؤ، كما يتوافق رقم الدورة مع أعلى مستوى طاقة لذرة العنصر.
على سبيل المثال: الصوديوم (Na) والبوتاسيوم (K) موجودان في نفس المجموعة (المجموعة 1)، وهذا يعني أن كلاهما يحتوي على إلكترون واحد في المستوى الخارجي ويتفاعلان بشكل مماثل مع العناصر الأخرى (كلاهما يتفاعل بسهولة مع الماء).
وعلى الرغم من ذلك، فإن منظمة الأيوباك ترشح استخدام الأرقام من 1 إلى 18 ، وهذه التصنيفات تعد الأكثر شيوعًا من أجل كتابة الجدول في صفحة واحدة، أو أجزاء من صفين، بمجموع 14 عمود غالبًا تُكتب أسفل الهيكل الأساسي للجدول الدوري.
تعتمد الطريقة التي تتفاعل بها الذرات مع بعضها البعض لتشكيل الروابط إلى حد كبير على موقعها في الجدول الدوري فالعناصر القريبة من بعضها في الجدول الدوري لها خصائص متشابهة وتميل إلى المشاركة في تفاعلات كيميائية مماثلة.
العديد من العناصر تختلف في خواصها الفيزيائية والكيميائية، ولكن بعض العناصر تتشابه في سلوكها الكيميائي على سبيل المثال: هناك العديد من العناصر تكون لامعة، لينة (أي يمكن إعادة تشكيلها دون أن تنكسر)، قابلة للسحب، وجيدة التوصيل للحرارة والكهرباء.
هناك عناصر أخرى ليست لامعة أو لينة، وغير قابلة للسحب، وضعيفة التوصيل للحرارة والكهرباء؛ لذلك يمكننا تصنيف العناصر إلى فئات كبيرة تبعاً للخواص المشتركة:
- الفلزات: عناصر تتميز باللمعان، وسهولة التشكيل، جيدة التوصيل للحرارة والكهرباء وذات لون أصفر.
- غير الفلزات: عناصر باهتة وغير لامعة، ضعيفة التوصيل للحرارة والكهرباء، وذات لون أخضر.
- أشباه الفلزات: عناصر متوسطة التوصيل الحراري والكهربي، لها بعض خواص الفلزات وبعض خواص اللافلزات وذات لون بنفسجي.
يمكن أيضاً تصنيف العناصر إلى:
- عناصر المجموعة الرئيسية: في الأعمدة 1 و2 ومن العمود 13 إلى 18.
- العناصر الانتقالية: في الأعمدة من 3 إلى 12.
- العناصر الانتقالية الداخلية: في صفين أسفل الجدول الدوري (الصف العلوي من العناصر الانتقالية الداخلية يسمى النثانيدات والصف السفلي يسمى ألكتيندات).
بالإضافة إلى ذلك يمكن تقسيم العناصر إلى أجزاء أصغر تبعاً لخواص أكثر تحديداً، مثل التركيب الكيميائي للمركبات التي تكونها على سبيل المثال: تحتوي المركبات في عناصر المجموعة الأولى على ذرة واحدة من العنصر وذرة واحدة من الهيدروجين.
العناصر في المجموعة الثانية تُكوّن مركبات تحتوي على ذرة واحدة من العنصر وذرتين من الهيدروجين (هذه العناصر تسمى الفلزات القلوية الأرضية)
هناك مجموعات أخرى بأسماء محددة مثل النكتوجين pnictogens (المجموعة 15)، الكالكوجين chalcogens
(المجموعة 16)، الهالوجين halogens (المجموعة 17)، الغازات النبيلة (المجموعة 18 وتعرف أيضاً باسم الغازات الخاملة).
يمكن أن يُشار إلى المجموعات أيضاً باسم أول عنصر في المجموعة على سبيل المثال: مجموعة الكالكوجين chalcogen يمكن أن تسمى بمجموعة الأكسجين أو عائلة الأكسجين.
يعد الهيدروجين عنصر فريد، لافلز يتميز بخواص مشابهة لخواص عناصر المجموعتين 1 و17؛ لهذا السبب الهيدروجين يظهر في قمة هاتين المجموعتين أو بشكل منفرد.
مجموعات وفترات الجدول الدوري
أولاً: الفترات
الفترات هي الصفوف الأفقية للجدول الدوري، هناك سبع فترات إجمالية وكل عنصر في الدورة له نفس عدد المدارات الذرية.
تحتوي الفترة العليا، التي تحتوي على الهيدروجين والهيليوم، على مدارين فقط ومع نزولك إلى أسفل الصفوف يزداد عدد المدارات.
| رقم الفترة | عدد المدارات | عدد العناصر |
| 1 | 1 | 2 |
| 2 | 2 | 8 |
| 3 | 3 | 8 |
| 4 | 4 | 18 |
| 5 | 5 | 18 |
| 6 | 6 | 32 |
| 7 | 7 | 32 |
ثانياً: المجموعات
توجد 18 مجموعة في الجدول الدوري، مجموعة واحدة في كل عمود، العمود الأول على اليسار هو المجموعة 1، والعمود الأخير على اليمين هو المجموعة 18.
المجموعة الأولى هي الأقل استقراراً لاحتوائها على إلكترون تكافؤ واحد فقط، وفي الوقت نفسه المجموعة الثامنة عشرة هي الأكثر استقرارا حيث أن هذه العناصر لها ثماني إلكترونات تكافؤ.
| رقم المجموعة | عدد إلكترونات التكافؤ |
| 1 | 1 |
| 2 | 2 |
| 12-3 | 2 |
| 13 | 3 |
| 14 | 4 |
| 15 | 5 |
| 16 | 6 |
| 17 | 7 |
| 18 | 8 |
هل يتغير الجدول الدوري الحديث
يُدار الجدول الدوري كما نعرفه اليوم من قبل الاتحاد الدولي للكيمياء البحتة والتطبيقية، أو ما يعرف ب (IUPAC).
في حين أن كثير من العناصر الموجودة في الجدول الدوري مستقرة ومن غير المرجح تغييرها، إلا أنّ منظمة IUPAC مسؤولة عن تحديد ما يجب تغييره، لهذا وضعوا معايير لما يشكل اكتشاف عنصر جديد.
بالإضافة إلى ذلك، يجب تعيين اسم ورمز مؤقت لأي عنصر جديد وفي حال تم التحقق من صحته يجب إعطاؤه اسمًا رسميًا.
كان هذا هو الحال عندما قام الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC) مؤخرًا بمراجعة العناصر 113 و115 و117 و118، وقرر منحها أسماء ورموزًا رسمية.
لا يقتصر التغيير على إضافة عناصر جديدة فقط أو استبدال أسماء بأخرى، وإنما يمكن تغيير الأوزان الذرية أيضاً، على سبيل المثال: كان الوزن الذري
للكربون[12.00 ] عام 1902، ولكنه اليوم [12.0096: 12.0116].
الخاتمة
مثّل اكتشاف الجدول الدوري تطورًا كبيرًا في علم الكيمياء، حيث ساعد في تنظيم وربط العلاقات بين العناصر الكيميائية وبعضها البعض، مما نتج عنه فهم أكثر لطبيعة المواد الكيمائية وطرق تفاعلها سويًا.
المصادر
1.Development of the periodic table، من موقع Periodic Table، أُطلع عليها بتاريخ11-2-2024.
2.Organization of the Periodic Table، من موقع libretexts، أُطلع عليها بتاريخ11-2-2024.
3.Periodic Table of Elements، من موقع pubchem، أُطلع عليها بتاريخ12-2-2024.
4.How to Read the Periodic Table، من موقع chemistrytalk، أُطلع عليها بتاريخ12-2-2024.






